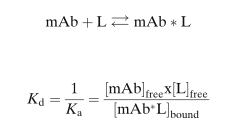本期《袁来如此》为系列文章《大分子生物分析概论》的第七篇,将重点就已发表的文献资料对抗体的总浓度和游离浓度的定量分析及其在药代动力学中的应用进行初步的介绍。
由于内容篇幅较长,本文将采取上下篇形式进行推送,敬请垂注!《袁来如此》专栏系广州九游会J9医药微信公众号打造的科普学术专栏,内容均为九游会J9医药子公司深圳博瑞副总经理袁智博士原创。
支持用于药物开发的生物分析的主要驱动力是数据的预期应用。配体结合式测试方法(LBA)被广泛用于蛋白质生物药和靶标配体(target ligands,L)的分析,以支持药代动力学/药效学(PK/PD)和安全性评估。特别是对于以非共价键结合其靶标配体的单克隆抗体药物(mAb),体内可以存在多种形式的mAb与其靶标配体,包括游离的mAb,游离的L以及mAb和L的一价和/或二价复合物(mono- and/or bivalent complexes of mAb and L)。
考虑到给药后体内发生的动态结合平衡的复杂性以及在生物分析过程中该平衡受到多种来源的扰动,对待测物的不同形态(游离、结合或总体mAb和L)以间接体内形式(ex vivo)进行定量分析得出的结果,可能与体内(in vivo)的实际情况不同。原则上,可以设计LBA试剂和测试格式,用于测定mAb和L的总浓度或游离浓度。
本文主要关注mAb生物药与血液循环中以可溶形式分泌出来的,或从膜受体上脱落的靶标配体和L。本文从理论和实践上研究了如何测定的总体/游离的待测物浓度,以提升科学界的相关认知,并提供了相关生物分析策略,以便在药物开发的特定阶段提供所需的PK/PD的信息。
基于靶向药理机制的生物药已经成为了当前颇具前景的药物开发方式。生物药主要由单克隆抗体(mAb)药物组成,很多个mAb已经FDA批准作为药物上市使用,预计未来将有更多相关药物获得进入市场。
定量测定血液循环中的mAb及其靶标配体(L)的可靠分析方法对于评估mAb的暴露量-响应关系、支持其有效性和安全性评价、治疗剂量的选择是至关重要的。配体结合测定法(LBA)通常用于定量分析mAb及其相关L的浓度,在生物体内环境中存在多种形式的mAb和L,包括游离mAb、游离L和 mAb和L的一价和/或二价复合物。当L是二聚体或多聚体时,则会产生额外的复杂性,可以设计LBA试剂和分析格式来进行测量,包括mAb及其L的结合及游离形态。这其中,确定LBA方法所测量的确切形态至关重要。
由于LBA的数据是用于评估药代动力学/药效学(PK/PD)关系,因此,为了适当评估PK/PD,使用相关的分析方法清楚地阐明mAb和L的相互作用是非常重要的。本文描述如下相关共识
(1) 有关mAb和L的信息在不同的药物开发阶段的用途;(3)对生物分析的挑战和相关警示(method caveats);同时,本文为选择mAb和L的总体和游离浓度的测定方法提供了一个实用的策略,将从以下方面阐述:
1. 提高药物开发界对特定的LBA方法测定mAb和L的各种形式(游离,结合,或总体/free, bound, or total)的重要性的认识。2. 介绍常见的生物分析策略及其局限性,以及这些分析方法在药物开发的各个阶段所面临的挑战。3. 识别并弥补数据提供者(生物分析科学家)和数据最终用户(药代动力学家、毒理学家和PK/PD建模人员)之间潜在的沟通不畅,在定义对数据的需求和理解内在的权衡和风险时。生物体液中游离、部分游离(partially free,也称为部分结合/ partially bound),结合(bound)全部(total)mAb和L的术语。对于mAb,将其“游离/free”部分实用性地定义为表现出与其未结合形式(unbound forms)相等同的生物活性的形式。由于mAbs的二价性,游离mAb既包括未结合(unbound)mAb,也包括部分结合mAbs(即一价结合的/monovalently bound),这些形式通常是使用未结合的参考标准物(unbound reference standards)来定量的。总体mAb将是完全结合形式(fully bound)、部分结合形式(partially bound)和非结合形式(unbound)的总和。
除了与mAb结合外,L还可以与其它蛋白质结合,并且L上可能有多个结合位点,具有或不具有协同效应。为了简化讨论,本文将不讨论L的多价结合(multivalent binding)和与近端蛋白(proximal protein)结合。在此,本文简化了靶标配体,L,的定量,只包括“游离”(非结合,Lfree)和总体(包括与mAb结合和非结合的形式,Ltotal);相应的参考标准物由特定的方法来确定。
虽然本文提供了一些文献中的案例研究和例子,但目的不是要包罗万象。为了避免文章冗长,不会详细讨论表1中的例子,只作为参考文献列出。有兴趣的读者可参阅相关文献。
生物分析战略的主要驱动力是使用这些数据为药物开发进行决策参考。取决于决策所需要的信息,在药物开发的不同阶段所需的数据以及因此所选择的定量方法(游离,全部,或两者都要)可能不同。
在药物开发的早期阶段,特定的试剂可能无法用于开发游离的mAb或L的分析方法。因此,生物分析科学家和数据使用者应了解并就下列问题进行交流:
(1)生物分析数据的预期用途;
(2)血液循环中mAb和L之间的动态平衡关系;
(3)分析方法的技术性挑战(technical challenges)及其实际局限性(practical limitations)。
表1. 有关生物体液和分析类型(Assay Types)中的待测物形式的术语

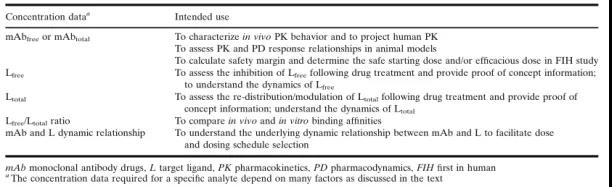
在临床前开发阶段, 血清mAb的浓度用于建立非临床物种中的PK行为,并预测首次人体给药(FIH)时的起始剂量 (表2)。靶标配体L的浓度用于评估mAb与L的动态平衡关系,以帮助确定具有生物活性的mAb浓度,并用于PK建模,从而确定给药剂量和方案。
临床阶段的数据则用于描述人体药代动力学特征,定义PK/PD与安全性和有效性的关系,并在目标患者人群中建立PK/PD模型,以支持药物的批准上市和使用以及药品标签。详细的PK/PD数据的应用列于表2和表3。
表2.临床前开发阶段药物和靶标浓度数据的用途
在许多情况下,生物药的药理效应是由游离的mAb和mAbfree所决定的。如果mAb与可溶性配体结合,以防止其与同源受体结合(或通过其传递信号)。如果能够在游离靶标配体与Lfree的结合与临床响应之间建立起相关性,与L的结合和捕获就可以作为PK/PD建模和给药方案选择时一个直接的生物标志物。虽然 mAbfree反映了mAb在体内的游离状态和结合能力,但评估mAbtotal可以进一步帮助描述mAb与L之间的动态相互作用。mAb/L的比值与其动态平衡(dynamic equilibrium)高度影响生物分析方法的特异性。因此,了解药物开发不同阶段所需的信息是十分重要。
表3.临床开发阶段药物和靶标配体浓度数据的用途

药代动力学家通常对mAbfree颇为敏感,因为mAbfree的水平反映了可利用的活性药物。当然,毒理学家也对mAbtotal非常敏感,因为mAb的靶向或脱靶效应(on- or off-target effects)可能带来安全隐患。因此,在使用这些数据之前,药代动力学家和毒理学家必须了解具体的生物分析方法是什么,并决定是否需要进行额外的分析。
就此而言,如果在药物开发的后期改变了定量分析方法,那么可能需要重新评估PK或PD模型,因为这些模型是基于特定的定量分析方法产生药物浓度-时间行为。从游离或结合的mAb的分析方法的角度,有综述分析了21个FDA已批准上市的mAb药物的LBA方法。这些报告大多没有具体说明分析方法的格式,因此不同分析方法产生的PK参数可能不一致。
由此来看,在制定mAb的生物分析策略时,重要的是与不同功能团队中的关键利益攸关方合作。包括药物开发项目所处的阶段,何时以及如何测定每个药物开发项目中的mAb和L。
质量作用定律支配着mAb和L的结合。
该定律首先是由Guldberg和Waage于1864年提出,并被广泛用于描述可逆性结合的相互作用(reversible binding interactions):从steroid hormones与其结合蛋白,到mAb和L的可逆性结合。一般选择对靶标配体(L)的有高结合亲和力(binding affinity)的mAb作为药物来开发,平衡解离常数(equilibrium dissociation constants,Kd)通常在几个nM到pM的浓度范围。结合动力学一般是非线性的、容量有限的(capacity limited),其结合符合二级动力学特征(second-order association)。
其中,Kd和Ka分别为平衡解离常数和结合常数。
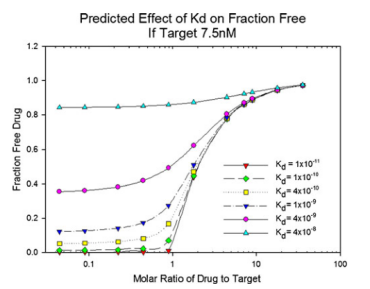
质量作用定律可用于计算或预测平衡中各组分的浓度。Le Chatelier原理也描述了平衡随浓度变化而移动的趋势。图1表明,mAb结合到L的部分(fraction of mAb bound to L),除取决于Kd外,还取决于mAb和L的浓度比值。
图1. 在一定的mAb/L摩尔比范围内,mAb-L亲和力对 mAbfree的影响。将L的浓度固定为常数,用于模拟计算 mAbfree。为了便于解释,本例中的摩尔比是基于假设每摩尔药物有一个结合位点;对于mAb,每摩尔药物有两个结合位点。
图1. 在一定的mAb/L摩尔比范围内,mAb-L亲和力对 mAbfree的影响。将L的浓度固定为常数,用于模拟计算 mAbfree。为了便于解释,本例中的摩尔比是基于假设每摩尔药物有一个结合位点;对于mAb,每摩尔药物有两个结合位点。
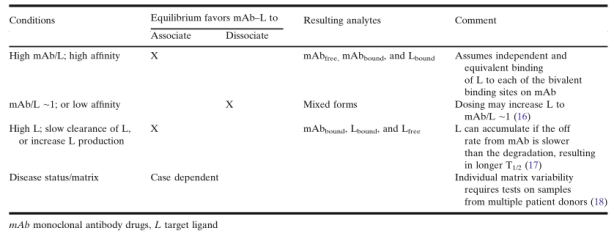
在给药后,一般假定mAb与可溶性L的结合遵循质量作用定律。因此,可以定量分析血浆或血清样本中mAb和L的浓度,以阐明PK/PD关系的动态平衡。如在《药物和靶点生物分析数据的应用》章节中所讨论的,根据质量作用定律的预测,mAb或L的体内平衡将以依赖于PK动力学和L的响应动力学的方式,向游离或结合状态移动,如表4所示的情况分类。高比例的mAb/L的第一种情况是高剂量的mAb与L具有高结合亲和性,这是药物开发中经常遇到的情况。 但在某些情况下,L可能会累积并在某些时间点导致mAb/L比值降低。Lfree和/或Ltotal的增加可能在给药后伴随L的积累而发生,并可能抵消抑制L的预期效果,或可能带来其他安全问题。
表4.给药方案和体内平衡对mAb和L的影响
除了考虑给药后mAb-L结合的体内动力学外,离体状况(ex vivo conditions)如样品采集、储存、运输和样本分析等可能使样本的平衡状态与体内(in vivo)状态大不相同。表5列出了一些可能影响结合或解离平衡动力学的状况。
在样品采集和分析过程中,由于平衡可能受到扰动,不同mAb和/或L的相关形式(游离的、结合的、总L和mAb)的离体定量可能会偏离体内的实际值。此外,偏差的程度取决于研究过程中样本采集的时间,因此,很难预测由这样的实验确定的PK/PD行为与体内的真实状况的相似程度。
表5.导致mAb和L的平衡转移的离体状况

在含有这些不同形式的混合物的样本中,而且当很难控制mAb和/或L的特定形式的平衡动力学时,将平衡驱动到主要以mAb和L的游离或结合(总体)的形式存在,然后进行定量分析的价值较大。此外,使用分离步骤来分离游离的和结合的形式,并定量特定的形式,以获得药物开发的每个阶段所需的PK或PD信息。许多LBA检测平台和条件都足够灵活,可以完成这项工作。
本文后续将分别在《抗体药物的定量生物分析方法》和《靶标配体的生物分析方法》章节中,讨论针对mAb和L的具体形式的多种定量方法。敬请垂注!
特别声明
本文如有疏漏和误读相关指南和数据的地方,请读者评论和指正。所有引用的原始信息和资料均来自已经发表学术期刊, 官方网络报道, 等公开渠道, 不涉及任何保密信息。参考文献的选择考虑到多样化但也不可能完备。欢迎读者提供有价值的文献及其评估。 扩展阅读

1. Lee JW, et al. Bioanalytical approaches to quantify “total” and “free” therapeutic antibodies and their targets: technical challenges and PK/PD applications over the course of drug development. AAPS J. 2011;13(1):99–110.2. Wang W, et al. Monoclonal antibody pharmacokinetics and pharmacodynamics. Clin Pharmacol Ther. 2008;84(5):548–58.3. DeSilva B, et al. Recommendations for the bioanalytical method validation of ligand-binding assays to support pharmacokinetic assessments of macromolecules. Pharm Res. 2003;20(11):1885–900.4. Lee JW, et al. Fit-for-purpose method development and validation for successful biomarker measurement. Pharm Res. 2006;23(2):312–28.5. Betts AM, et al. The application of target information and preclinical pharmacokinetic/pharmacodynamic modeling in predicting clinical doses of a Dickkopf-1 antibody for osteoporosis. J Pharma-col Exp Ther. 2010;333(1):2–13.6. Kuang B, et al. Therapeutic monoclonal antibody concentration monitoring: free or total? Bioanalysis. 2010;2(6):1125–40.7. Baulieu EE. Some aspects of the mechanism of action of steroid hormones. Mol Cell Biochem. 1975;7(3):157–74.8. Reverberi R, Reverberi L. Factors affecting the antigen-antibody reaction. Blood Transfus. 2007;5(4):227–40.9. Lobo ED, Hansen RJ, Balthasar JP. Antibody pharmacokinetics and pharmacodynamics. J Pharm Sci. 2004;93(11):2645–68.10. Salimi-Moosavi H, et al. Novel approaches using alkaline or acid/guanidine treatment to eliminate therapeutic antibody interference in the measurement of total target ligand. J Pharm Biomed Anal. 2010;51:1128–33.11. Ezan E, Dubois M, Becher F. Bioanalysis of recombinant proteins and antibodies by mass spectrometry. Analyst.2009;134(5):825–34.12. Dubois M, et al. Immunopurification and mass spectrometric quantification of the active form of a chimeric therapeutic antibody in human serum. Anal Chem. 2008;80(5):1737–45.13. Hagman C, et al. Absolute quantification of monoclonal antibodies in biofluids by liquid chromatography-tandem mass spectrometry. Anal Chem. 2008;80(4):1290–6.14. Heudi O, et al. Towards absolute quantification of therapeutic monoclonal antibody in serum by LC-MS/MS using isotope-labeled antibody standard and protein cleavage isotope dilution mass spectrome-try. Anal Chem. 2008;80(11):4200–7.15. Luna LG, et al. Ultra performance liquid chromatography isotope dilution tandem mass spectrometry for the absolute quantification of proteins and peptides. Anal Chem. 2008;80(8):2688–93.16. Wang KY, et al. Multiplexed immunoassay: quantitation and profiling of serum biomarkers using magnetic nanoprobes and MALDI-TOF MS. Anal Chem. 2008;80(16):6159–67.17. Lowe PJ, et al. Relationship between omalizumab pharmacokinetics, IgE pharmacodynam-ics and symptoms in patients with severe persistent allergic (IgE-mediated) asthma. Br J Clin Pharmacol. 2009;68(1):61–76.18. Lachmann HJ, et al. In vivo regulation of interleukin 1beta in patients with cryopyrin-associated periodic syndromes. J Exp Med. 2009;206(5):1029–36.19. Hormbrey E, et al. A critical review of vascular endothelial growth factor (VEGF) analysis in eripheral blood: is the current literature meaningful? Clin Exp Metastasis. 2002;19(8):651–63.20. Beum PV, et al. Three new assays forrituximab based on its immunological activity or antigenic properties: analyses of sera and plasmas of RTX-treated patients with chronic lymphocytic leukemia and other B cell lymphomas. J Immunol Meth. 2004;289(1–2):97–109.21. Beer PM, et al. Vitreous levels of unbound bevacizumab and unbound vascular endothelial growth factor in two patients. Retina.2006;26(8):871–6.22. Blasco H, et al. Evaluation of a peptide ELISA for the detection of rituximab in serum. J Immunol Meth. 2007;325(1–2):127–39.23. Ceze N, et al. An enzyme-linked immunosorbent assay for therapeutic drug monitoring of cetuximab. Ther Drug Monit. 2009;31(5):597–601.24. Davis RA, et al. A novel method for quantitative measurement of a biomarker in the presence of a therapeutic monoclonal antibody directed against the biomarker. J Pharm Biomed Anal. 2008;48(3):897–901.25. Li H, et al. Development of a method for the sensitive and quantitative determination of hepcidin in human serum using LC-MS/MS. J Pharmacol Toxicol Meth. 2009;59(3):171–80.26. Wang R, et al. The profile of soluble amyloid beta protein in cultured cell media. Detection and quantification of amyloid beta protein and variants by immunopre-cipitation-mass spectrometry. J Biol Chem. 1996;271(50):31894–902.