

























随着审评审批制度改革和鼓励创新的持推进以及《真实世界证据支持药物研发与审评的指导原则(试行)》《真实世界证据支持儿童药物研发与审评的技术指导原则(征求意见稿)》的相继出台,真实世界研究成为业界关注的焦点。
鉴于业界对真实世界研究的概念、设计原则、实施步骤和方法、数据分析与解读等尚缺乏清晰的认知。日前,经中国医药质量管理协会批准,由临床研究质量与评价专业委员会主办,九游会J9医药承办的真实世界研究系列直播讲座重磅启动,该直播讲座旨在围绕真实世界数据和真实世界证据进行全面解读。
系列直播首场便邀请到了北京协和医学院基础学院研究员单广良为广大网友解读真实世界数据与证据、真实世界研究类型、分享真实世界研究设计实施、数据处理、统计方法以及真实世界数据的理性分析和解读。
以下是单广良教授直播内容整理。
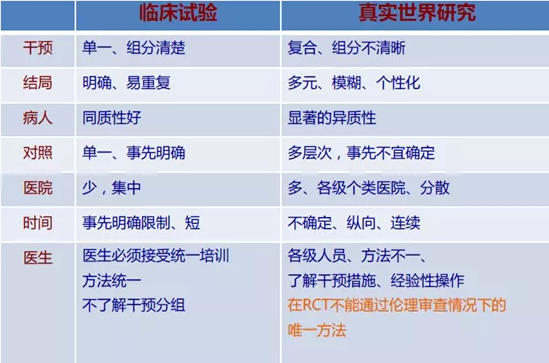
真实世界(Real World)最早见于1993年Kaplan发表的关于雷米普利上市后评价研究。真实世界研究(Real World Study,RWS),就是起源于药物上市后评价的实用性临床研究。开始时是药物在临床实践中应用的进一步评价,对患者不加过多的筛选条件限制,干预措施接近临床实际场景,旨在评价药物在实际应用条件下的有效性、安全性和效果。
经过多年的发展和实践,对真实世界研究的定义逐步达成共识,有组织有计划地使用观察性研究方法,收集统一的临床及相关数据,对某一特定疾病的人群,或暴露在某一特定因素下的人群进行特定结局的评价,从而达到制定和完善临床决策和医保政策目的的一种研究方法。
我国现有典型的真实世界数据包括:
区域医疗健康数据库
医院电子病历数据
医保数据
公共卫生调查与公共健康监测
出生/死亡登记数据
患者登记数据
了解疾病的临床特征和治疗效果全貌
评估临床医生遵循指南的现状和更新需求
评估不同医疗中心的医疗质量
评估治疗措施综合效益
国家医药和医保在政策制定的依据
上市药品和医疗器械有效性和安全性的再评价
国际多中心注册研究可使医生和管理者对国家间疾病特征和医疗质量进行比较
O: Outcomes |
S: Study design |
T: Time span |
E: Electronic medical record system |
R: Result analysis and interpretation |

